纳米尺度蛋白质分析
Get the pdf download to your inbox:
Tau蛋白作为一种微管稳定因子而广为人知[1]。这种微管相关蛋白(MAP)特异性表达于神经元中,主要定位于轴突远端区域。Tau蛋白的过度磷酸化会降低其与微管的亲和力,导致其聚集成配对螺旋纤维(PHFs)和神经原纤维缠结(NFTs),从而改变突触连接并引发神经退行性病变。Tau蛋白的聚集与高度磷酸化是阿尔茨海默病(AD)中细胞死亡的神经毒性标志。尽管空间分辨率有限,但研究表明通过FTIR方法检测1070 cm⁻¹附近的磷酸基团红外吸收峰,可实现磷酸化修饰的识别[2]。本应用说明将采用IR PiFM化学成像技术,对转基因阿尔茨海默病小鼠脑切片中Tau蛋白的纳米尺度聚集行为进行可视化研究。

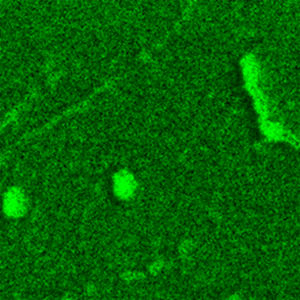
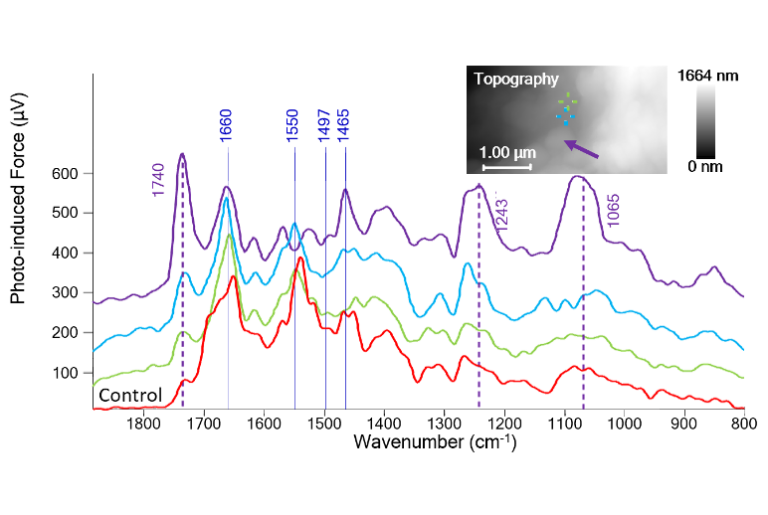
图1展示了来自TG样本(阿尔茨海默病模型)的三组PiF-IR光谱(浅绿、蓝、紫色)及对照组(非阿尔茨海默病)的PiF-IR光谱;插图为脑切片AFM形貌图,并标注光谱采集位点。TG样本的浅绿与蓝色光谱与对照组光谱相似,均显示显著的酰胺I带(1660 cm⁻¹)与酰胺II带(1550 cm⁻¹)特征峰,以及较弱强度的1740 cm⁻¹(脂质酯基C=O伸缩振动)、1243 cm⁻¹(磷脂PO₂⁻不对称伸缩振动)和1065 cm⁻¹(磷脂对称伸缩振动)特征峰。在TG样本类聚集体特征处采集的紫色PiF-IR光谱显示1740、1243及1065 cm⁻¹处峰强度显著增强,而酰胺峰强度减弱。图2展示了1744 cm⁻¹与1060 cm⁻¹波数采集的PiFM图像及同区域AFM形貌图。可见两幅PiFM图像凸显相同特征结构,该现象很可能源于磷酸化修饰;需注意纳米尺度特征在兩幅图像中均得到良好重现。目前难以判断PiFM特征是否与形貌特征存在关联性。

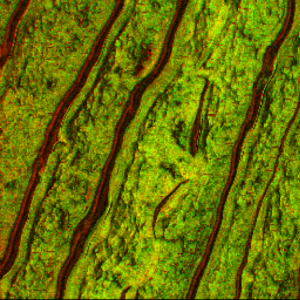
图3展示了分别通过酰胺I带(红色,1650 cm⁻¹)标记周围组织、磷酸基团对称伸缩振动(绿色,1740 cm⁻¹)标记磷酸化蛋白的TG与对照样本形貌及PiFM图像。两样本AFM形貌高度相似,均呈现高达数微米的高度起伏特征。同样,1650 cm⁻¹波数PiFM图像显示的周围组织特征也极为相似。然而,1740 cm⁻¹波数显示的磷酸化蛋白聚集态图像则呈现显著差异:对照样本中两波数图像基本重合,表明脂质均匀分布于组织中;而阿尔茨海默病样本的1740 cm⁻¹图像不仅显示脂质/组织背景(在形貌起伏较小的中上部区域最清晰),还显现出遍布组织的大量聚集体——我们将其归因于磷酸化修饰。
自组装蛋白笼
自组装蛋白可作为”智能”生物材料的构建单元,充分利用蛋白质丰富的结构与功能特性。该领域已设计出诸如二十面体蛋白笼等新型自组装结构。由于二十面体蛋白笼能封装大体积物质,常被用于疫苗设计与靶向药物递送。
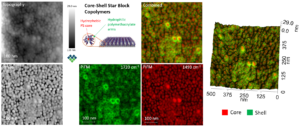
图4比较了三种不同放大倍数(扫描尺寸)的PiFM图像与单个自组装二十面体蛋白笼的SEM图像。PiFM图像通过分次扫描采集以验证其特殊形状(非完全圆形)与内部信号对比度的可重复性。PiFM图像显示的尺寸与类六边形轮廓与同放大倍数的SEM图像高度吻合(图像按等比例尺显示)。PiFM图像显示笼内对比度差异,暗示不同晶面存在——其棱与面表现出不同的酰胺I带(1666 cm⁻¹)信号强度;由于激发光主要沿针轴方向偏振,该图像显示了酰胺I带的偏振依赖性响应。PiFM图像旁附二十面体笼示意图,以标注图像中暗示的晶面结构。更多细节参见文献[3]。

参考文献
- Cell Biochem Funct. 2020, 38, 686–694
- “FT-IR analysis of phosphorylated protein,” Proc. SPIE 5461, Biophotonics New Frontier: From Genome to Proteome, (8 September 2004)
- J. Am. Chem. Soc. 2019, 141, 23, 9207-9216
Interested in a niche application?
Ask us, we may have already studied it.